通知公告
北京大学肿瘤医院医学伦理委员会关于临床试验安全性事件报告的流程与要求
根据 2020 年 7 月 1 日生效的新版 GCP 要求,我院医学伦理委员会对临床试验安全性事件报告的流程与要求做出相应调整,规定如下:
一、递交流程及时限
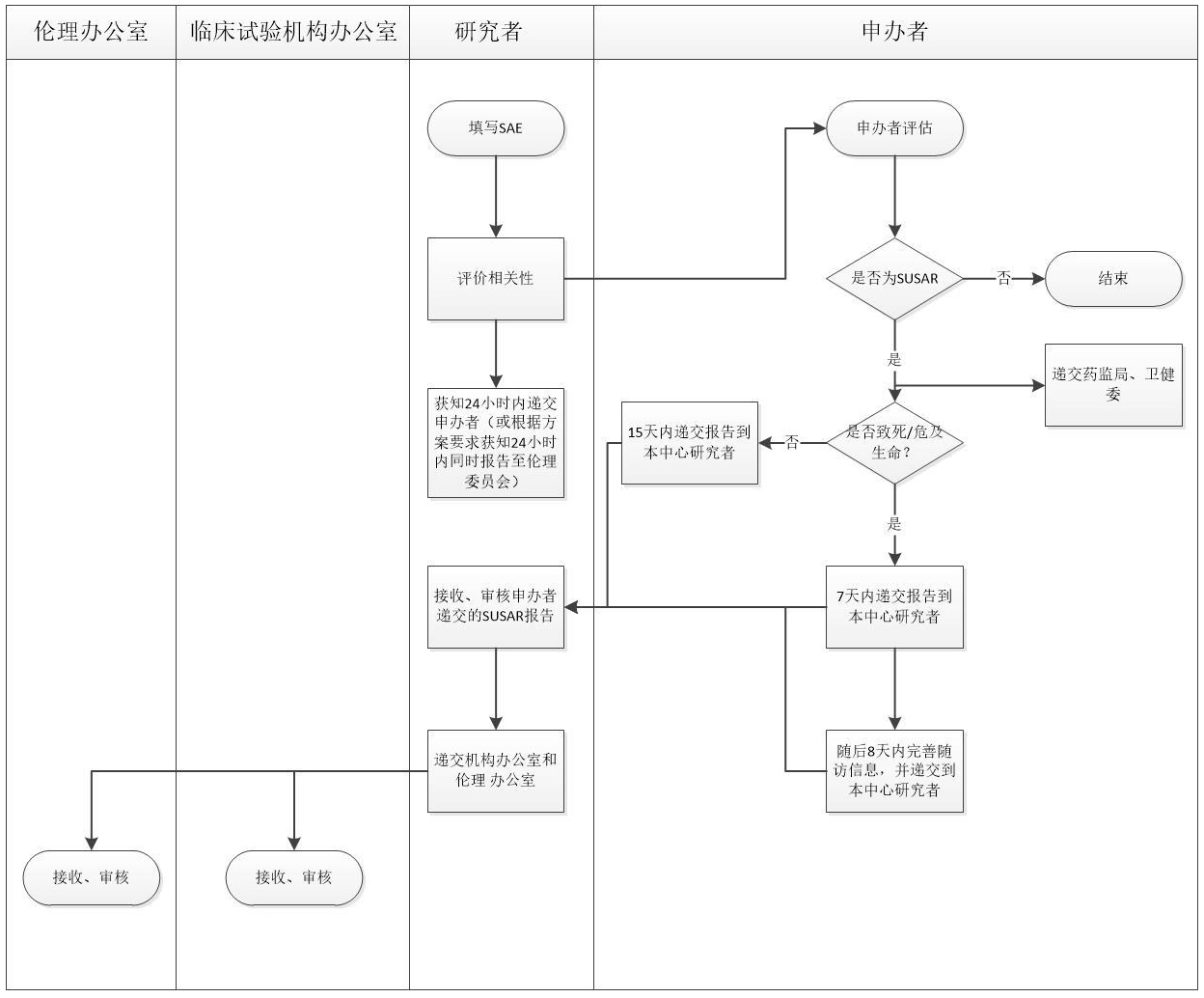
1. 本院发生的严重不良事件(SAE)
研究者应在获知后 24 小时内向申办者提交书面报告,除试验方案或者其他文件(如研究者手册)中规定不需立即报告的 SAE 外。研究者认为需立即向伦理委员会报告的、或根据临床试验方案需立即向伦理委员会报告的 SAE,需在获知后 24 小时内上报。
2. 可疑且非预期严重不良反应(SUSAR)
2.1 对于致死或危及生命的非预期严重不良反应,申办者应在首次获知后(获知当天为第 0天)7 日内报告,在随后的 8 日内完善随访信息并报告;对于非致死或危及生命的 SUSAR,申办者应在首次获知后 15 日内报告。
2.2 研究者审阅申办者提供的 SUSAR 报告后,应在 24 小时内向伦理委员会报告。
2.3 申办者递交 SUSAR 汇总信息时,应提供汇总列表,至少每 3 个月集中报告一次。
3. 研发期间安全性更新报告(DSUR)
作为阶段性的安全性汇总,申办者需要将 DSUR 有关信息上报给药监局和卫健委,同时反馈给研究者审阅,研究者审阅后签署伦理委员会递交信,与 DSUR 一并递交至伦理委员会审查,至少一年报告一次。
二、递交方式与要求
1. 递交方式
1.1 申请人及时将安全性信息上传至伦理信息系统。伦理办公室在信息系统中接收文件进行形式审查,并将合格的文件按照本中心伦理审查的 SOP 安排会议审查/快速审查/备案,及对审查意见进行反馈。
1.2 纸质版材料在伦理形式审查通过后及时递交至伦理办公室存档。(备注:材料递交请根据伦理办公室相关通知,在系统上提前预约)
2. 文件要求
2.1 伦理递交信:研究者审阅后填写并签署“伦理委员会递交信”,正确勾选安全性信息相关内容,并说明是否需要调整受试者的治疗或修改研究方案/知情同意书等。
2.2 SUSAR 报告:SUSAR 报告的填写应采用标准化、结构化的信息,保证填写信息的完整;纸版汇总列表原则上应为简体中文或中英文对照,应包含 SUSAR 的发生时间、诊断、对研究药物采取的措施、转归等内容;对于非本中心的 SUSAR 个例安全性报告:经申办者和研究者评估,对于本中心受试者的风险和受益无影响的可定期报告,如对于本中心受试者的风险和受益可能有影响的应及时递交至伦理委员会。
2.3 DSUR 报告:申办者应提供完整的 DSUR 信息,并对报告周期内收集到的与在研药物(无论上市与否)相关的安全性信息进行全面深入的定期回顾和持续评估,如:对受试者的风险进行评估、定期报告的分析结果、研究药物的安全性,针对安全性问题提出或采取的解决措施等内容。
北京大学肿瘤医院医学伦理委员会
二〇二〇年八月二十日
附件 1:临床试验安全性事件报告流程
附件 2:
递 交 信
尊敬的北京大学肿瘤医院医学伦理委员会:
您好!
由北京大学肿瘤医院 XXX 科 XXX 教授/主任申办的题为“XXXXXXXXXXXXXXXXXXXXXXXX”
的项目,已在我院开展。随信附上以下材料(临床试验安全性事件信息),敬请伦理委员会审
批。
1、XXXXXX
2、XXXXXX
……
研究者(PI)关于此次递交的安全性事件信息的审阅意见(如有):
XXXXXXXXX
研究者签字:
签字日期:
伦理委员会回执
伦理委员会已收到上述材料。
伦理委员会接收人签字:
签字日期: